In de rubriek ’10 vragen over’ beantwoorden experts veelvoorkomende vragen over een bepaald onderwerp. Test je kennis met de onlinetoets.
Hoe herken je een levensbedreigende necrotiserende wekedeleninfectie? En hoe behandel je patiënten met recidiverende cellulitis van het onderbeen? Dit artikel geeft een overzicht van de verschillende infectieziekten van de weke delen, de bijbehorende diagnostiek en de behandeling.
Toets voor nascholing
Aan dit leerartikel is een toets gekoppeld waarmee je nascholingspunten kan verdienen. De toets is beschikbaar tot 21 maart 2026.
Overzicht van te behalen accreditatiepunten
| Specialisme | Punt(en) |
|---|---|
| Alle BIG-erkende specialismen | 1 |
- Deze toets geldt voor alle BIG-erkende specialismen en levert je 1 nascholingspunt op. De toets is geaccrediteerd door ABAN, NAPA, KNMP en NVZA.
- De toets telt mee binnen en buiten het eigen vakgebied voor medisch specialisten, huisartsen, sociaal geneeskundigen,specialisten ouderengeneeskunde, apothekers en physician assistants. De accreditatie geldt niet voor verpleegkundig specialisten.
- De toewijzing van punten verloopt via PE-online (het herregistratiesysteem) na het invullen van je BIG-nummer.
Samenvatting
Wekedeleninfecties komen frequent voor, maar kunnen lastig zijn om te diagnosticeren en te behandelen. In dit artikel beschrijven we de classificatie, de diagnostische mogelijkheden en de behandelopties van wekedeleninfecties. Verder beschrijven we de behandeling van recidiverende wekedeleninfecties en necrotiserende wekedeleninfecties. Daarbij gaan we dieper in op de toegevoegde waarde van zwachtelen en op de betekenis van toename van roodheid onder behandeling.
Leerdoelen
- Weten hoe je cellulitis en erysipelas kunt onderscheiden van andere aandoeningen.
- Weten wat het verschil is tussen een cellulitis, erysipelas en een necrotiserende wekedeleninfectie.
- De rol kennen van compressietherapie in de behandeling van wekedeleninfecties en de preventie ervan.
- Weten wat de plaats is van antibiotische profylaxe bij recidiverende wekedeleninfecties.
artikel
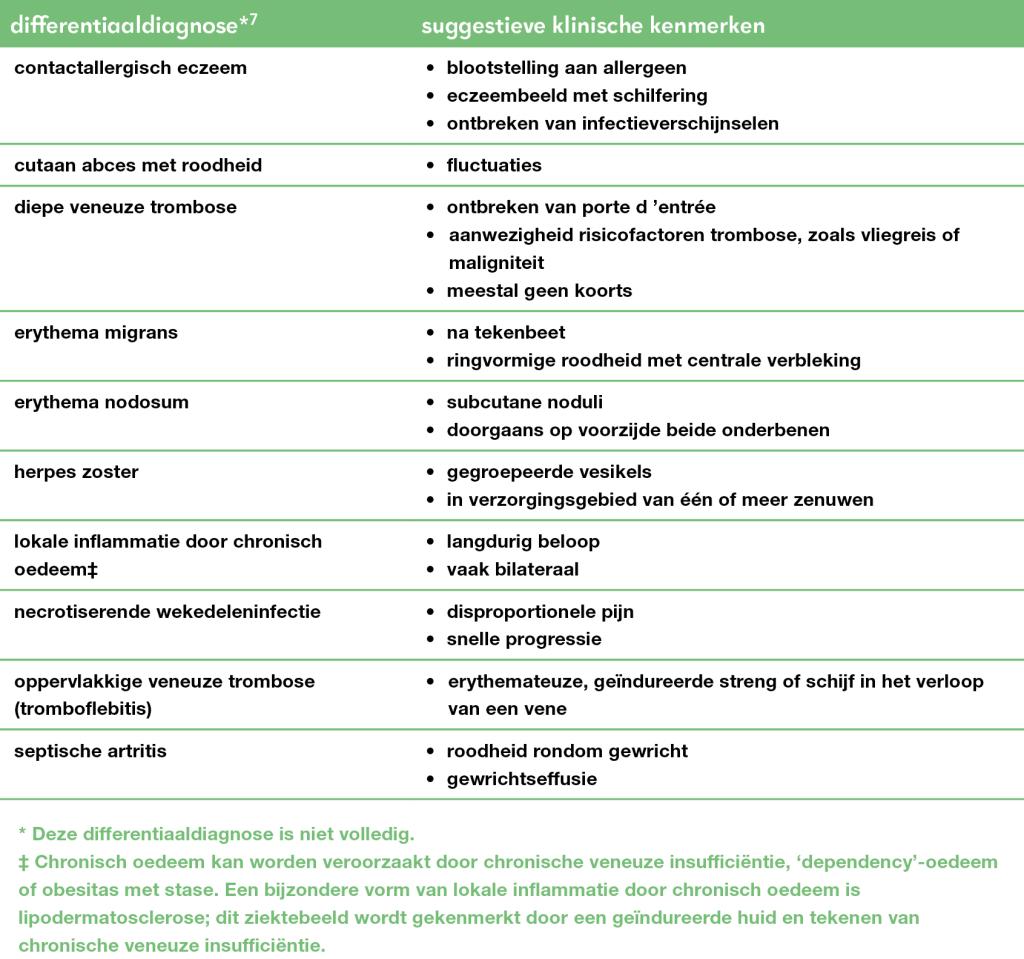
Wekedeleninfecties komen frequent voor in de eerste en tweede lijn. De incidentie in de huisartsenpraktijk van erysipelas en cellulitis is 5-10 per 1000 personen per jaar, van wie naar schatting 10% in de tweede lijn terechtkomt.1 De meest voorkomende lokalisatie is de onderste extremiteit, maar ook in het gelaat of op de romp komen wekedeleninfecties regelmatig voor. De infectie ontstaat doordat een bacterie het lichaam binnendringt via een (klein) defect in de huid, beter bekend als de ‘porte d’entrée’. Aandoeningen die de huidbarrière verstoren, zoals eczeem, dermatomycose of een trauma, zijn daarom belangrijke risicofactoren voor wekedeleninfecties. Andere risicofactoren zijn vaatlijden, pre-existent oedeem door bijvoorbeeld verminderde lymfeafvloed, overgewicht en een eerder doorgemaakte wekedeleninfectie.
Hoewel wekedeleninfecties frequent voorkomen, kan de diagnostiek en behandeling moeilijk zijn, zeker als het beeld niet direct verbetert nadat behandeling is ingezet. In dit artikel behandelen we tien relevante vragen uit de praktijk over de diagnostiek, behandeling en het beloop van wekedeleninfecties.
Definitie
Welke classificatie is in de praktijk het meest bruikbaar?
Van oudsher wordt er onderscheid gemaakt tussen erysipelas, cellulitis en necrotiserende wekedeleninfectie.2
Erysipelas is een acute bacteriële infectie van de huid en de oppervlakkige lagen van de subcutis. De aandoening kenmerkt zich door een scherp begrensde, pijnlijke, verheven roodheid van de huid, systemische verschijnselen en koorts (figuur 1). De verwekker van erysipelas is vrijwel altijd een hemolytische streptokok van groep A (Streptococcus pyogenes). De toxines die vrijkomen zorgen voor de systemische verschijnselen: hoge koorts, misselijkheid, braken, diarree en lokale weefseldestructie, waarbij zwelling, blaarvorming en necrose kunnen voorkomen. Opvallend is dat de lokale verschijnselen nog kunnen uitbreiden in de eerste 48-72 uur van de antibiotische therapie, ook al is die adequaat. Dit wordt toegeschreven aan toxineproductie die al heeft plaatsgevonden voordat de antibiotische therapie is ingezet.
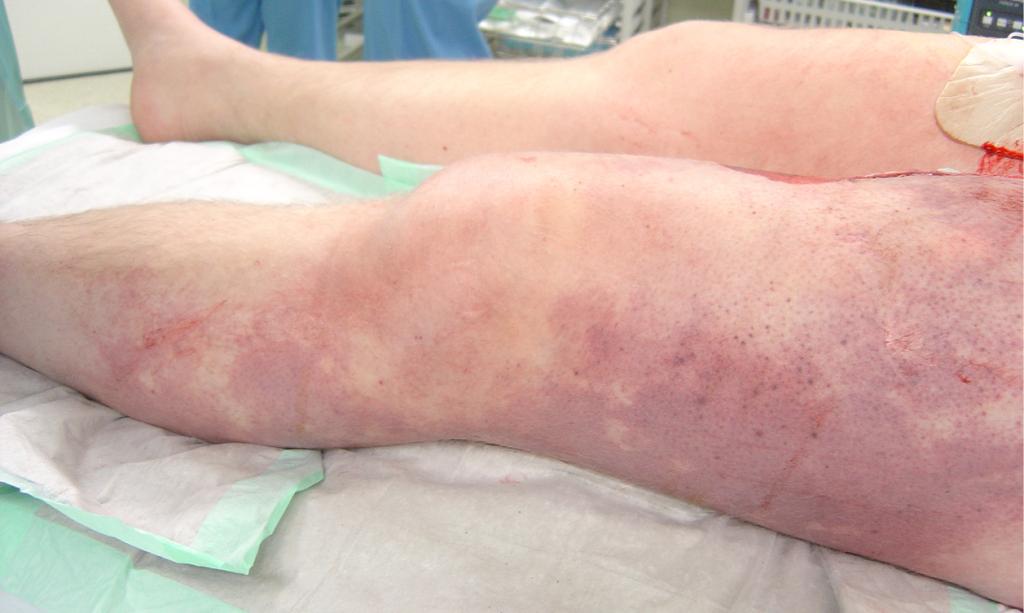
Cellulitis verloopt minder acuut dan erysipelas. Het betreft een infectie van de diepere huidlagen, zoals het onderhuidse vet- en bindweefsel. De roodheid is daardoor onscherp begrensd en minder vurig rood (figuur 2). Naast de eerdergenoemde groep A-streptokokken is Staphylococcus aureus een belangrijke verwekker. Cellulitis wordt vaker gezien bij patiënten met pre-existente (chirurgische) wonden of een slechte arteriële vaatstatus. Toxines spelen een minder belangrijke rol dan bij erysipelas en de lokale weefseldestructie is over het algemeen minder ernstig.
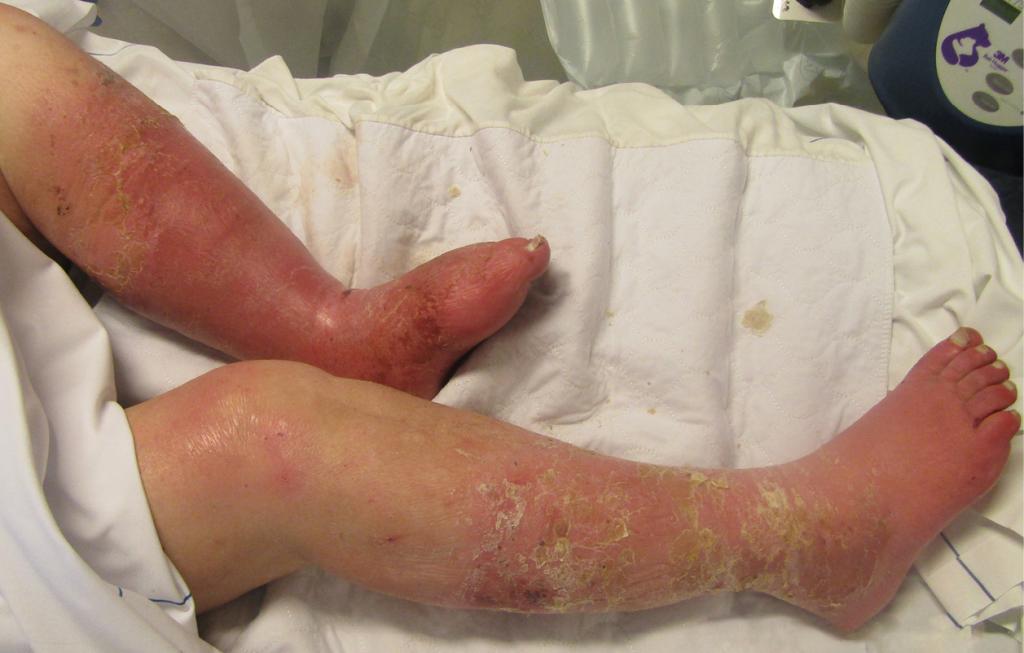
Necrotiserende wekedeleninfecties, waarvan fasciitis necroticans de bekendste is, zijn infecties van de subcutis waarbij ook de diepe fascie is aangedaan (figuur 3). Hierdoor ontstaan vaatafsluitingen, necrose en ernstige systemische toxine-gemedieerde ziekteverschijnselen. In eerste instantie kan het klinisch beeld sterk lijken op dat van cellulitis, maar disproportionele pijn en zeer snelle progressie moeten de clinicus doen denken aan een necrotiserende wekedeleninfectie. Vanwege de hoge mortaliteit en de noodzaak tot spoedige chirurgische behandeling is het onderscheid van levensbelang, zoals eerder beschreven in het NTVG.3 De incidentie is laag, wereldwijd variërend van 0,2 tot 6,9 per 100.000 persoonsjaren.4 Necrotiserende wekedeleninfecties kunnen zowel een monomicrobiële als polymicrobiële origine hebben. Daarbij zijn de meeste voorkomende verwekkers de groep A-streptokok, S. aureus, Enterobacterales en Clostridium perfringens.
Omdat het klinisch onderscheid tussen erysipelas en cellulitis niet altijd duidelijk is, aanvullende diagnostiek hiernaar ontbreekt en de behandeling niet verschilt, wordt dit onderscheid niet meer gemaakt in de Nederlandse behandelrichtlijnen; erysipelas wordt beschouwd als een specifieke vorm van cellulitis.5-7 In feite zijn erysipelas en cellulitis de twee uiterste entiteiten op een continuüm dat wordt aangeduid met de term ‘cellulitis/erysipelas’. De classificatie met enerzijds cellulitis – en de bijbehorende subvariant erysipelas – en anderzijds necrotiserende wekedeleninfecties is in de praktijk goed bruikbaar.
Naast de hier beschreven algemene ziektebeelden zijn er nog enkele bijzondere uitingsvormen die specifieke aanpak vereisen, zoals cellulitis orbitae, flegmone van de hand en gangreen van Fournier. Deze bijzondere ziektebeelden laten we in dit artikel buiten beschouwing.
Diagnostiek
Wat zijn belangrijke aandachtspunten bij lichamelijk onderzoek?
Het lichamelijk onderzoek richt zich naast de huidverschijnselen op systemische ziekteverschijnselen. Koorts is een belangrijk klinisch kenmerk. Wanneer koorts ontbreekt moet de diagnose ‘wekedeleninfectie’ kritisch worden heroverwogen.
Punten van aandacht zijn de kleur, omvang en begrenzing van de lokale huidafwijking en eventuele bijkomende lymfangitis en locoregionale lymfadenopathie. De zwelling van de huid kan zo uitgebreid zijn dat er bullae ontstaan. Let op fluctuatie van de huid om een eventueel onderliggend abces te lokaliseren.
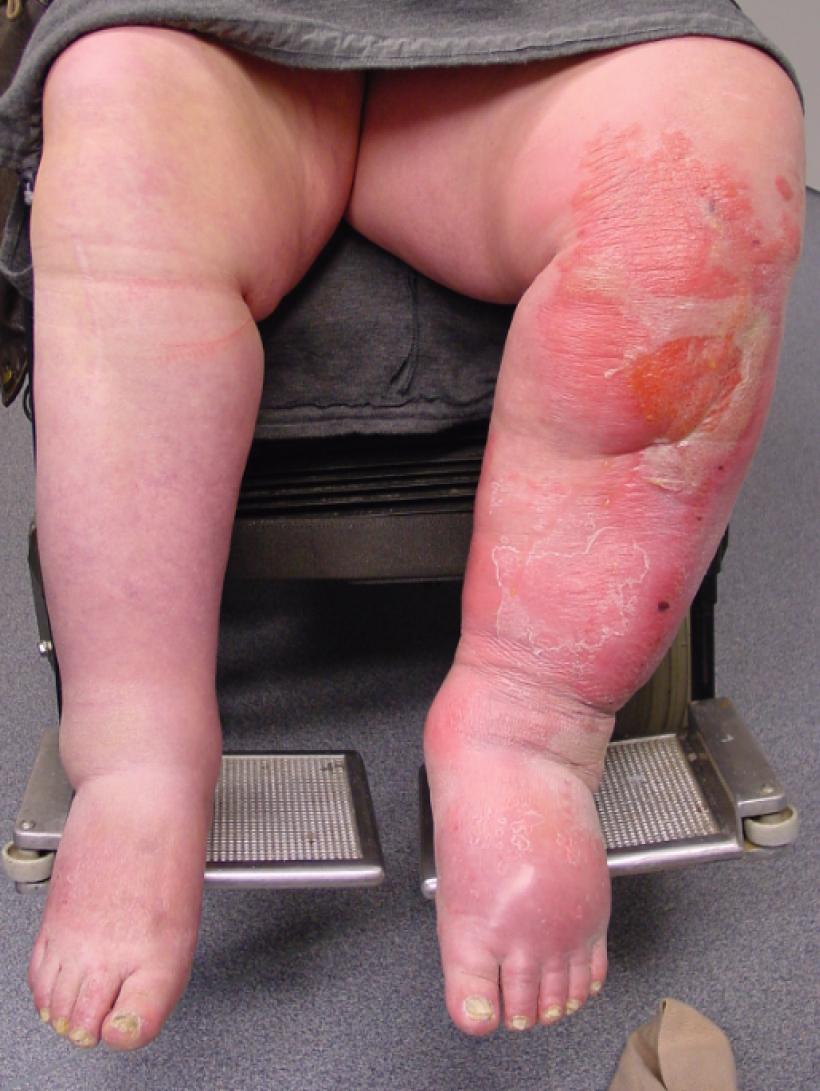
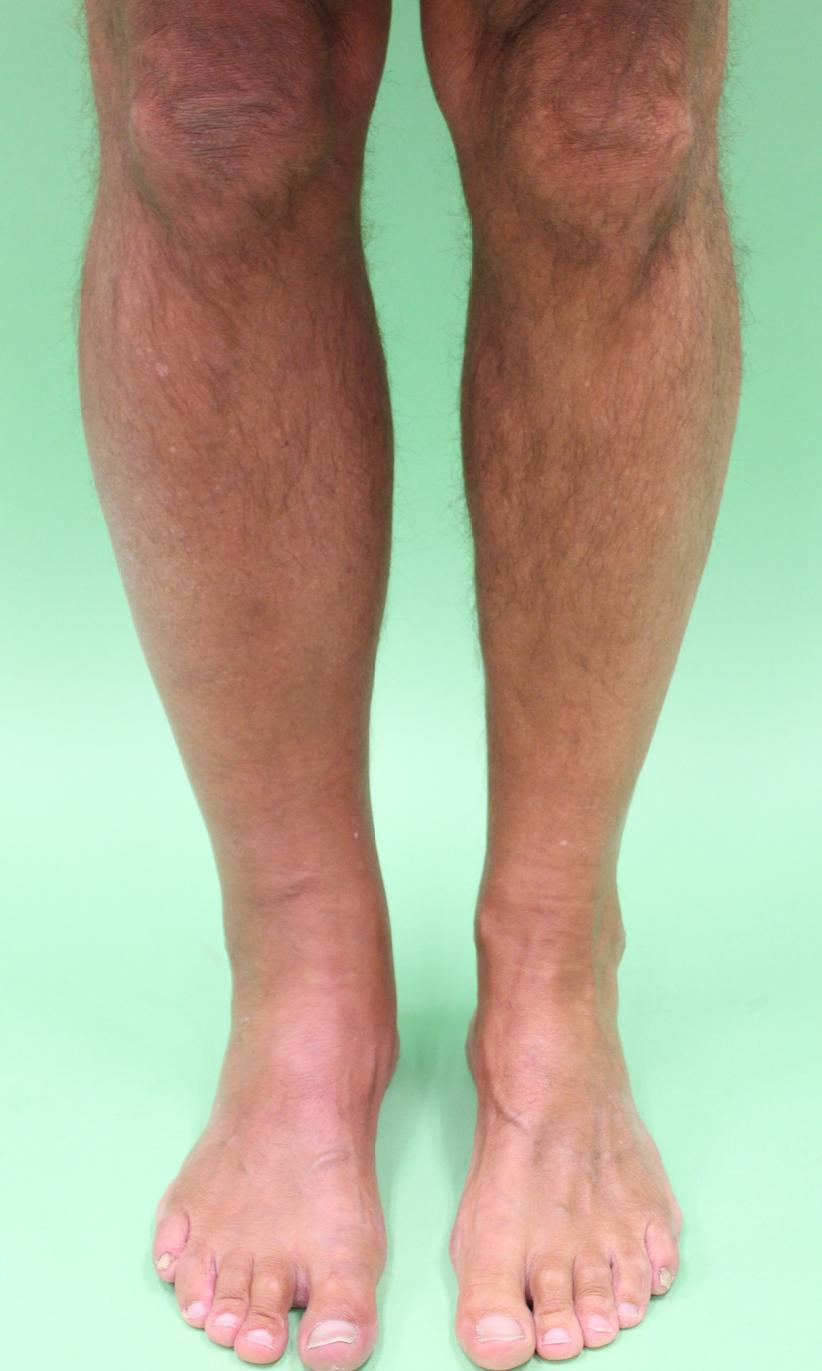
Bilaterale roodheid aan de benen berust nagenoeg nooit op een infectieuze origine en leidt met enige regelmaat tot het onterecht voorschrijven van antibiotica. Bilaterale afwijkingen passen bij lokale inflammatie met chronisch oedeem en ontstaan bijvoorbeeld bij patiënten met chronische veneuze insufficiëntie, ‘dependency’-oedeem of obesitas (figuur 4).8
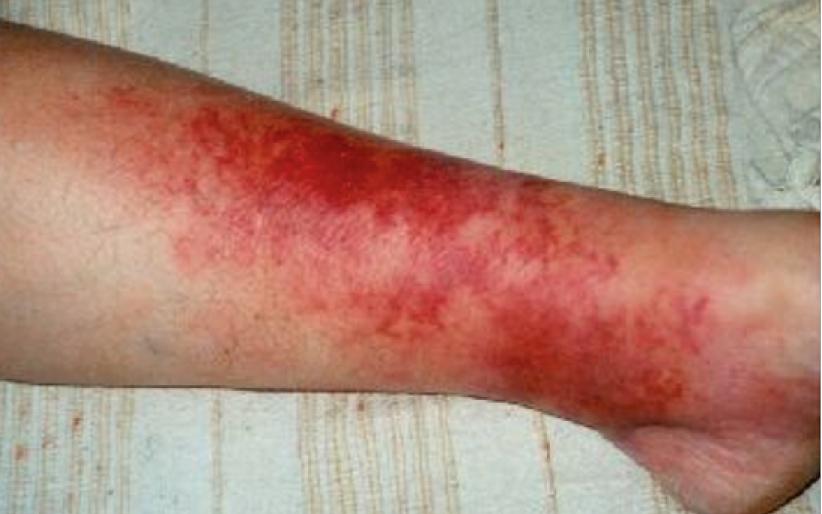
In de acute fase van een cellulitis van het onderbeen kan het onderscheid met oppervlakkige of diepe veneuze trombose moeilijk zijn (figuur 5). Systemische ziekteverschijnselen, zoals koorts en malaise, kunnen helpen dit onderscheid te maken (tabel 1). Extra aandacht is geboden voor patiënten met een donkere huidskleur, bij wie roodheid minder zichtbaar kan zijn. Eerder werd in het NTVG beschreven dat Nederlandse dermatologieboeken weinig afbeeldingen van bruine huid bevatten, waardoor het diagnostisch proces vertraagd kan worden.9
Afhankelijk van de locatie moet er bij wekedeleninfecties aandacht zijn voor nabijgelegen kwetsbare structuren, zoals de orbitae bij een infectie in het gelaat, of medisch kunstmateriaal nabij de infectiehaard. Verder is het zinvol om bij het lichamelijk onderzoek de porte d’entrée te lokaliseren, zodat die eveneens behandeld kan worden. Daarmee kan het risico op een recidief worden verlaagd.
Welke laboratoriumonderzoeken zijn aangewezen?
Bij een ongecompliceerd beloop van een wekedeleninfectie is laboratoriumonderzoek in de eerste lijn niet aangewezen. De aan- of afwezigheid van koorts en de eerdergenoemde ziekteverschijnselen zijn voldoende richtinggevend. De ontstekingsparameters zijn vrijwel altijd verhoogd, maar kunnen in de acute fase soms nog niet-afwijkend zijn; de mate van verhoging hangt niet samen met het klinische beloop. Een CRP-bepaling kan wel nuttig zijn om het onderscheid te maken tussen een infectie of een niet-infectieuze aandoening, bijvoorbeeld bij twijfel tussen een cellulitis en geïndureerd oedeem.
Welk onderzoek naar de verwekker moet plaatsvinden?
In de eerste lijn is diagnostiek naar de verwekker niet vereist bij een wekedeleninfectie bij patiënten die immuuncompetent en niet ernstig ziek zijn en die niet zijn blootgesteld aan bijzondere risico’s. Bij deze patiënten is de verwekker bijna altijd een stafylokok of streptokok en heeft het aantonen van de verwekker geen consequenties voor de behandeling.10,11 Bovendien leveren bloedkweken of kweken van de porte d’entrée maar zelden een verwekker op.12
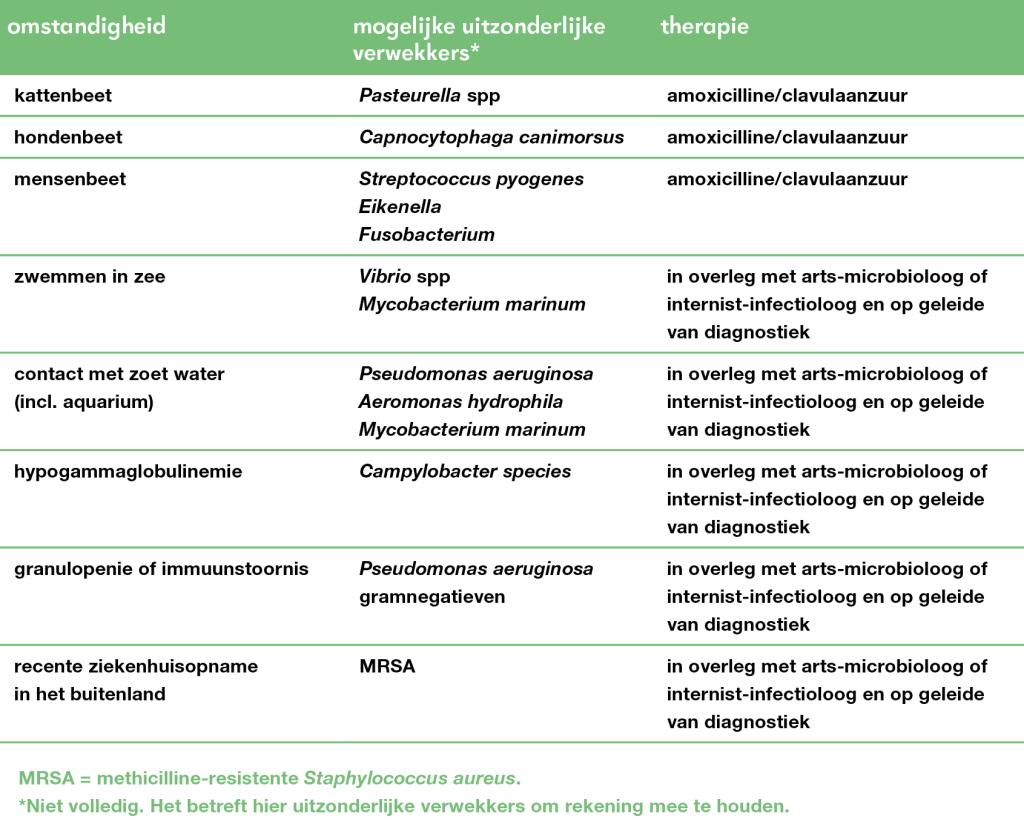
Een immuunstoornis of bijzondere exposities, zoals een bezoek aan de tropen, een dierenbeet of veelvuldig contact met zoet water, geven een verhoogd risico op een minder gangbare verwekker of een ernstig beloop. In die gevallen kan aanvullende microbiologische diagnostiek – bloedkweken en wondkweken bij een manifest huiddefect – en behandeling in de tweede lijn wel bijdragen aan een betere uitkomst.13 Daarnaast is het bij patiënten met een verhoogd risico op MRSA-dragerschap – bijvoorbeeld na een ziekenhuisopname in het buitenland – zinvol om MRSA-diagnostiek in te zetten op materiaal van de huidafwijking, neus, keel en het perineum. Serologisch onderzoek, zoals een antistreptolysine O-titer (AST) voor groep A-streptokokken, is over het algemeen niet zinvol, aangezien de titer pas na 1 tot 4 weken stijgt.
Welke bevindingen wijzen op een necrotiserende wekedeleninfectie?
In de vroege fase is een necrotiserende wekedeleninfectie vaak moeilijk te herkennen. Aanvankelijk treedt een onscherp begrensd erytheem op met lokale zwelling. Kenmerkend zijn hevige, disproportionele pijn, snelle progressie van de lokale symptomen en het optreden van systemische verschijnselen. Daarnaast kunnen crepitaties voorkomen, maar dat hoeft zeker niet altijd.
Beeldvormend onderzoek heeft een heel beperkte rol en kan juist tot ongewenste vertraging leiden. Bij het klinische vermoeden van een necrotiserende wekedeleninfectie is chirurgische exploratie de gouden standaard. De chirurg inspecteert daarbij de fascie. Een CT-scan kan overwogen worden bij chirurgisch lastig te bereiken gebieden, een negatieve eerste exploratie of progressie na necrotectomie.14
Behandeling
Cellulitis en erysipelas
Welk antibioticum heeft de voorkeur bij cellulitis en erysipelas?
De richtlijn van de Stichting Werkgroep Antibioticabeleid (SWAB) adviseert bij een klassieke presentatie van erysipelas behandeling met feneticilline of benzylpenicilline, gericht tegen β-hemolytische streptokokken. Bij cellulitis wordt flucloxacilline aanbevolen (4 dd 500 mg per os of 4 dd 1000 mg intraveneus), zodat ook andere verwekkers worden gedekt, zoals S. aureus. In de praktijk is, zoals eerder genoemd, het onderscheid tussen erysipelas en cellulitis vaak moeilijk en wordt over het algemeen flucloxacilline voorgeschreven.
Bij ongeveer 10% van de mensen wordt flucloxacilline oraal niet goed geresorbeerd.15,16 Wanneer flucloxacilline per os niet effectief is bij een patiënt met een klassieke cellulitis, kan worden overgegaan op een alternatief middel, bijvoorbeeld clindamycine. Wanneer sprake is van een ernstige β-lactamallergie volgens de in 2022 verschenen SWAB-richtlijn, kan clindamycine worden voorgeschreven als middel van eerste keus.17 Bij cellulitis door S. aureus kan resistentie voor clindamycine echter een probleem zijn.
Gebruik van macroliden wordt ontraden. Bij bijzondere exposities, een hoog risico op MRSA of bij immuungecompromitteerde patiënten moet overwogen worden zeldzamere verwekkers van cellulitis specifieker te behandelen (tabel 2).
De Nederlandse richtlijnen adviseren om gedurende 10-14 dagen te behandelen. In de Amerikaanse richtlijn wordt een kortere behandelduur van 5 dagen aangeraden, met een eventuele verlenging bij aanhoudende klachten.18 Een recente meta-analyse uit het Verenigd Koninkrijk onderschrijft dit.19 Zowel de Amerikaanse richtlijn als de Britse meta-analyse zijn voornamelijk gebaseerd op één studie. Daarin werd antibiotische behandeling gedurende 5 dagen vergeleken met een behandelduur van 10 dagen bij patiënten met cellulitis in de eerste of tweede lijn.20 De studie liet geen verschil zien in uitkomst, maar de patiënten die na de eerste 5 dagen onvoldoende opknapten deden niet mee in de randomisatie. Het gaat dus om een selecte groep van ‘goede’ patiënten bij wie de behandeling verkort zou kunnen worden.
Een Nederlandse gerandomiseerde studie bij patiënten die waren opgenomen vanwege cellulitis vergeleek behandeling met flucloxacilline gedurende 6 dagen met een 12-daagse flucloxacillinekuur.21 De studie liet geen verschil zien in het herstel op korte termijn, maar mogelijk wel meer recidieven op lange termijn in de groep die 6 dagen was behandeld.21 Kanttekening bij deze studie is dat het beoogde aantal inclusies niet werd gehaald en dat de patiënten die 6 dagen waren behandeld, vaker een episode van cellulitis in de voorgeschiedenis hadden.22 Concluderend lijkt er vooralsnog onvoldoende bewijs te zijn om de behandelduur te verkorten, maar is dat bij bepaalde patiënten waarschijnlijk wel mogelijk.
Naast de antibiotische behandeling moet ook de porte d’entrée worden behandeld. Daarmee kan een recidief mogelijk worden voorkómen. Denk daarbij bijvoorbeeld aan de behandeling van eczeem of dermatomycose. Daarnaast is het bij erysipelas en cellulitis van het been van belang maatregelen te nemen die de zwelling doen verminderen.11
Is het nuttig om te zwachtelen bij bijkomend oedeem?
De medisch-specialistische richtlijn adviseert op basis van expert opinion om ambulante compressietherapie in ieder geval in te zetten bij aanhoudend oedeem na een doorgemaakte infectie (enkele weken); zodra het oedeem is verdwenen wordt aangeraden om over te gaan op een elastische kous. Maar ook in de acute infectiefase is er volgens dermatologen een rol voor compressietherapie, in het bijzonder bij patiënten met preexistent chronisch oedeem. Het is hierbij belangrijk om je te realiseren dat bij 79% van de patiënten met een enkele, eenzijdige erysipelas van het been zonder risicofactoren een lymfe-afvloedstoornis wordt gevonden aan beide benen, wat een preexistente bilaterale lymfatische beperking suggereert.23 Vroegtijdig beginnen met compressietherapie, bijvoorbeeld na enkele dagen, zorgt voor snellere oedeemreductie, waardoor het risico op een recidief verlaagd wordt.24
In de praktijk wordt het belang van compressietherapie in de vroege fase regelmatig onderschat, maar zeker bij chronisch oedeem en recidiverende erysipelas is chronische compressietherapie middels een therapeutische elastische kous bewezen effectief ter voorkoming van recidieven.25 Arteriële insufficiëntie is een reden om af te zien van compressietherapie. Het is daarom goed om vooraf de capillaire hervullingstijd (‘capillary refill’) te beoordelen. Een enkel-armindex is zeker niet standaard geïndiceerd. Bij twijfel kan worden gekozen voor een licht compressieverband met lagere druk.
Is uitbreiding na enkele dagen verontrustend en moet ik dat monitoren?
Niet zelden ontstaat er onrust vanwege uitbreiding van de roodheid buiten de afgetekende lijnen of tekenen van weefseldestructie binnen de eerste 48-72 uur na aanvang van de antibiotische behandeling. Dit duidt over het algemeen niet op een falende behandeling of ongecontroleerd voortschrijden van de infectie, maar op het toxine-gemedieerde natuurlijke beloop. Terwijl de koorts vaak snel verdwijnt, kan de roodheid na het begin van de behandeling nog enkele dagen uitbreiden, en wordt de schade aan de weke delen pas na enkele dagen zichtbaar, bijvoorbeeld door blaarvorming.
In een Noorse studie naar het beloop bij patiënten die waren opgenomen vanwege cellulitis had minder dan 50% van de patiënten een reductie van klachten na behandeling gedurende één dag, en 90% na drie dagen.26 Verwachtingsmanagement van de patiënt en de dokter zijn dus van belang; als de patiënt niet zieker (koorts, toename pijn) wordt, is lokale uitbreiding van de roodheid gedurende de eerste 72 uur van de behandeling over het algemeen geen reden om de therapie aan te passen. Goede instructies aan de patiënt en verwijzing naar de pagina over wondroos van thuisarts.nl kunnen hierbij helpen.27
Wat is het beleid bij recidiverende wekedeleninfecties?
Eén op de acht patiënten met een eerste episode van erysipelas aan de onderste extremiteiten krijgt een recidief.28 Na een eerste recidief is het risico op een volgend recidief zelfs 30% in de daaropvolgende drie jaar. Beschadiging van de lymfevaten wordt beschouwd als de oorzaak van het steeds hogere risico op een volgend recidief. Vermoedelijk speelt de β-hemolytische streptokok hierbij de belangrijkste rol.
Bij recidiverende wekedeleninfecties is het ten eerste van belang om onderhoudende factoren, zoals oedeem, eczeem en tinea pedis, zoveel mogelijk te verhelpen. Compressietherapie is effectief in het verlagen van recidieven bij chronisch oedeem.25
Voor de dagelijkse praktijk betekent dat eerst zwachtelen met bandages en daarna een adequate therapeutisch elastische kous gedurende drie maanden, vaak een steunkous met naad (vlakbrei). Wanneer de zwelling aanhoudt is verdere diagnostiek naar de oorzaak aangewezen.7 Daarnaast kan gewichtsreductie bij patiënten met obesitas een gunstig effect hebben op het lymfoedeem en het risico op recidiverende wekedeleninfecties.24,29 Bij een recidief is herevaluatie van de lymfoedeembehandeling gewenst en moet de compressie indien nodig worden aangepast. Antibioticaprofylaxe in de vorm van orale of intramusculaire penicilline of orale feneticilline is eveneens bewezen effectief in het verlagen van het recidiefrisico: van patiënten met minimaal twee eerdere episodes van erysipelas kreeg 22% een recidief onder penicillineprofylaxe versus 37% in de placebo-arm.30 Dit effect verdween overigens geleidelijk weer na het stoppen van de profylaxe. In een oudere studie was het recidiefrisico 40% in de placebogroep en 10% in de profylaxegroep.31
Het voordeel van orale feneticilline is dat het de patiënt een maandelijkse pijnlijke injectie met benzathinebenzylpenicilline bij de huisarts bespaart. Fenoxymethylpenicilline wordt altijd volledig vergoed (m.u.v. het eigen risico). Dit middel wordt tweemaal daags gedoseerd. Feneticilline heeft de voorkeur aangezien het eenmaal per dag kan worden gegeven, wat de therapietrouw ten goede komt. Behandeling met dit middel vereist echter vaak een bijbetaling van de patiënt (gemiddeld € 0,82 per capsule, tot een maximum van € 250,- per jaar).32,33
Voor onderhoudsbehandeling met flucloxacilline is geen plaats: het is onnodig breed, geeft meer bijwerkingen en de resorptie kan hierbij een probleem vormen. Bij een cellulitis door S. aureus of het vermoeden daarvan is geen voordeel aangetoond van eradicatiebehandeling – dit in tegenstelling tot bij furunculose. Verschillende studies laten geen verband zien tussen S. aureus-dragerschap en het risico op cellulitis.34,35
Necrotiserende wekedeleninfecties
Wat is de behandeling van een necrotiserende wekedeleninfectie?
De behandeling van necrotiserende wekedeleninfecties is primair chirurgisch. Directe operatieve exploratie is essentieel, zowel voor de diagnose als voor de behandeling met een debridement. Daarnaast dient direct intraveneus een breedspectrumantibioticum te worden toegediend en de weefselperfusie te worden geoptimaliseerd. Empirische antibiotische therapie – bij een nog onbekende verwekker – bestaat uit een β-lactamantibioticum als ceftriaxon in combinatie met clindamycine; bij hemodynamische instabiliteit komt daar een aminoglycoside bij. Hiermee worden de belangrijkste verwekkers gedekt – zowel grampositieven als gramnegatieven en anaeroben. Clindamycine blokkeert daarnaast de toxineproductie.
Hoe effectief intraveneuze immuunglobulines (IVIG) zijn in het neutraliseren van toxines bij necrotiserende wekedeleninfecties staat nog altijd ter discussie. In een Amerikaanse ‘propensity-matched’-studie en een Deense gerandomiseerde studie naar IVIG bij necrotiserende fasciitis door alle verwekkers werd geen overlevingsvoordeel gezien.36,37 In een Scandinavische studie waarin alleen patiënten met een necrotiserende wekedeleninfectie door β-hemolytische streptokokken werden geïncludeerd, werd wel een overlevingsvoordeel van IVIG gezien.38 De Nederlandse richtlijn adviseert IVIG te geven wanneer er streptokokken worden gezien in het grampreparaat en deze behandeling te stoppen zodra de verwekker géén groep A-streptokok blijkt te zijn.14 Diezelfde richtlijn adviseert bovendien om hyperbare zuurstoftherapie te overwegen, na adequate necrotectomie.
Tot besluit
Wekedeleninfecties komen vaak voor en behoeven meestal geen aanvullende diagnostiek in de eerste lijn. Bij bijzondere exposities, ernstige ziekte en immuungecompromitteerde patiënten kan aanvullende diagnostiek wel aangewezen zijn. Tot 72 uur na aanvang van adequate therapie kan de roodheid nog uitbreiden door toxinevorming. Recidieven treden frequent op en kunnen worden voorkómen door adequate compressietherapie, behandeling van de porte d’entrée en eventueel aanvullende antibioticaprofylaxe. Bij het vermoeden van een necrotiserende wekedeleninfectie moet de patiënt met spoed worden verwezen naar de Spoedeisende hulp.
Literatuur
- Goettsch WG, Bouwes Bavinck JN, Herings RM. Burden of illness of bacterial cellulitis and erysipelas of the leg in the Netherlands. J Eur Acad Dermatol Venereol. 2006;20(7):834-839. doi:10.1111/j.1468-3083.2006.01657.x. Medline
- Bisno AL, Stevens DL. Streptococcal infections of skin and soft tissues. N Engl J Med. 1996;334(4):240-245. doi:10.1056/NEJM199601253340407. Medline
- Niessen FA, de Jong VM, Janssen S, Boel CHE. Richtlijn ‘Necrotiserende wekedeleninfecties’. Ned Tijdschr Geneeskd. 2020;164:D4737.
- Hua C, Urbina T, Bosc R, et al. Necrotising soft-tissue infections. Lancet Infect Dis. 2023;23(3):e81-e94. doi:10.1016/S1473-3099(22)00583-7. Medline
- FMS-richtlijn ‘Cellulitis-Erysipelas onderste extremiteiten’. Utrecht: Nederlandse Vereniging voor Dermatologie en Venereologie; 2013.
- NHG-standaard ‘Bacteriele huidinfecties’. Utrecht: Nederlands Huisartsen Genootschap; 2019.
- Lavrijsen APMDR, Komen DJ. Richtlijn NVDV ‘Erysipelas en cellulitis’. Utrecht; Nederlandse Vereniging voor Dermatologie en Venereologie; 2018.
- Verdonk H, Devoogdt N, Damstra R. Oedeem en oedeemtherapie. Houten: Bohn Stafleu van Loghum Houten; 2022.
- Dekkers LMB, Isik U, Sanders CJG, Dilaver G. Donkere huid zelden afgebeeld in Nederlandse dermatologieboeken. Ned Tijdschr Geneeskd. 2023;167:D7332.
- Jeng A, Beheshti M, Li J, Nathan R. The role of beta-hemolytic streptococci in causing diffuse, nonculturable cellulitis: a prospective investigation. Medicine. 2010;89(4):217-226. doi:10.1097/MD.0b013e3181e8d635. Medline
- Swartz MN. Clinical practice. Cellulitis. N Engl J Med. 2004;350(9):904-912. doi:10.1056/NEJMcp031807. Medline
- Gunderson CG, Martinello RA. A systematic review of bacteremias in cellulitis and erysipelas. J Infect. 2012;64(2):148-155. doi:10.1016/j.jinf.2011.11.004. Medline
- Raff AB, Kroshinsky D. Cellulitis: A Review. JAMA. 2016;316(3):325-337. doi:10.1001/jama.2016.8825. Medline
- FMS-richtlijn ‘Necrotiserende wekedeleninfecties’. Utrecht: Nederlandse Vereniging voor Heelkunde; 2018.
- Dijkmans AC, Hartigh J, van Dissel JT, Burggraaf J. A simplified oral flucloxacillin absorption test for patients requiring long-term treatment. Ther Drug Monit. 2012;34(3):356-358. doi:10.1097/FTD.0b013e318257e8ac. Medline
- Dijkmans AC, Kweekel DM, Balmforth C, et al. The simplified oral flucloxacillin absorption test: an accurate method to identify patients with inadequate oral flucloxacillin absorption. Neth J Med. 2019;77(7):255-260 Medline.
- Wijnakker R, van Maaren MS, Bode LGM, et al. The Dutch Working Party on Antibiotic Policy (SWAB) guideline for the approach to suspected antibiotic allergy. Clin Microbiol Infect. 2023;29(7):863-875. doi:10.1016/j.cmi.2023.04.008. Medline
- Stevens DL, Bisno AL, Chambers HF, et al; Infectious Diseases Society of America. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis. 2014;59(2):e10-e52. doi:10.1093/cid/ciu296. Medline
- Cross ELA, Jordan H, Godfrey R, et al. Route and duration of antibiotic therapy in acute cellulitis: A systematic review and meta-analysis of the effectiveness and harms of antibiotic treatment. J Infect. 2020;81(4):521-531. doi:10.1016/j.jinf.2020.07.030. Medline
- Hepburn MJ, Dooley DP, Skidmore PJ, Ellis MW, Starnes WF, Hasewinkle WC. Comparison of short-course (5 days) and standard (10 days) treatment for uncomplicated cellulitis. Arch Intern Med. 2004;164(15):1669-1674. doi:10.1001/archinte.164.15.1669. Medline
- Cranendonk DR, Opmeer BC, van Agtmael MA, et al. Antibiotic treatment for 6 days versus 12 days in patients with severe cellulitis: a multicentre randomized, double-blind, placebo-controlled, non-inferiority trial. Clin Microbiol Infect. 2020;26(5):606-612. doi:10.1016/j.cmi.2019.09.019. Medline
- Advani SD, Schwartz IS, Spivak ES, Sutton JD. Re: ‘Antibiotic treatment for 6 days versus 12 days in patients with severe cellulitis’ by Cranendonk et al. Clin Microbiol Infect. 2020;26(5):654-655. doi:10.1016/j.cmi.2019.11.023. Medline
- Damstra RJ, van Steensel MA, Boomsma JH, Nelemans P, Veraart JC. Erysipelas as a sign of subclinical primary lymphoedema: a prospective quantitative scintigraphic study of 40 patients with unilateral erysipelas of the leg. Br J Dermatol. 2008;158(6):1210-1215. doi:10.1111/j.1365-2133.2008.08503.x. Medline
- Burian EA, Karlsmark T, Franks PJ, Keeley V, Quéré I, Moffatt CJ. Cellulitis in chronic oedema of the lower leg: an international cross-sectional study. Br J Dermatol. 2021;185(1):110-118. doi:10.1111/bjd.19803. Medline
- Webb E, Neeman T, Bowden FJ, Gaida J, Mumford V, Bissett B. Compression Therapy to Prevent Recurrent Cellulitis of the Leg. N Engl J Med. 2020;383(7):630-639. doi:10.1056/NEJMoa1917197. Medline
- Bruun T, Oppegaard O, Hufthammer KO, Langeland N, Skrede S. Early Response in Cellulitis: A Prospective Study of Dynamics and Predictors. Clin Infect Dis. 2016;63(8):1034-1041. doi:10.1093/cid/ciw463. Medline
- Wondroos. www.thuisarts.nl/wondroos/ik-heb-wondroos, geraadpleegd op 22 januari 2024.
- Cannon J, Dyer J, Carapetis J, Manning L. Epidemiology and risk factors for recurrent severe lower limb cellulitis: a longitudinal cohort study. Clin Microbiol Infect. 2018;24(10):1084-1088. doi:10.1016/j.cmi.2018.01.023. Medline
- Nitti MD, Hespe GE, Kataru RP, et al. Obesity-induced lymphatic dysfunction is reversible with weight loss. J Physiol. 2016;594(23):7073-7087. doi:10.1113/JP273061. Medline
- Thomas KS, Crook AM, Nunn AJ, et al; U.K. Dermatology Clinical Trials Network’s PATCH I Trial Team. Penicillin to prevent recurrent leg cellulitis. N Engl J Med. 2013;368(18):1695-1703. doi:10.1056/NEJMoa1206300. Medline
- Sjöblom AC, Eriksson B, Jorup-Rönström C, Karkkonen K, Lindqvist M. Antibiotic prophylaxis in recurrent erysipelas. Infection. 1993;21(6):390-393. doi:10.1007/BF01728920. Medline
- Feneticilline – Kosten. www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/f/feneticilline#kosten, geraadpleegd op 22 januari 2024.
- Betaalbaar houden van geneesmiddelen www.rijksoverheid.nl/onderwerpen/geneesmiddelen/betaalbaar-houden-van-geneesmiddelen, geraadpleegd op 22 januari 2024.
- Eells SJ, Chira S, David CG, Craft N, Miller LG. Non-suppurative cellulitis: risk factors and its association with Staphylococcus aureus colonization in an area of endemic community-associated methicillin-resistant S. aureus infections. Epidemiol Infect. 2011;139(4):606-612. doi:10.1017/S0950268810001408. Medline
- Jauneikaite E, Ferguson T, Mosavie M, et al. Staphylococcus aureus colonization and acquisition of skin and soft tissue infection among Royal Marines recruits: a prospective cohort study. Clin Microbiol Infect. 2020;26(3):381.e1-381.e6. doi:10.1016/j.cmi.2019.07.014. Medline
- Kadri SS, Swihart BJ, Bonne SL, et al. Impact of intravenous immunoglobulin on survival in necrotizing fasciitis with vasopressor-dependent shock: a propensity score-matched analysis rrom 130 US hospitals. Clin Infect Dis. 2017;64(7):877-885 Medline.
- Madsen MB, Hjortrup PB, Hansen MB, et al. Immunoglobulin G for patients with necrotising soft tissue infection (INSTINCT): a randomised, blinded, placebo-controlled trial. Intensive Care Med. 2017;43(11):1585-1593. doi:10.1007/s00134-017-4786-0. Medline
- Bruun T, Rath E, Madsen MB, et al; INFECT Study Group. Risk factors and predictors of mortality in Streptococcal necrotizing soft-tissue infections: a multicenter prospective study. Clin Infect Dis. 2021;72(2):293-300. doi:10.1093/cid/ciaa027. Medline
- Garssen FP, Goslings JC, Bouman CS, Beenen LF, Visser CE, de Jong VM. Necrotiserende wekedeleninfecties: diagnostiek en behandeling. Ned Tijdschr Geneeskd. 2013;157:A6031. Medline.



Reacties